L’ipotesi atomica di Dalton

Oggi ci appare cosa ovvia e nota da sempre che la materia sia fatta di atomi mentre si dimentica che la teoria della costituzione intima della materia è una conquista scientifica relativamente recente. Solo nel 1808 infatti il chimico inglese John Dalton (1766-1844) individuò la legge delle proporzioni multiple, una osservazione che metteva in luce l’aspetto discontinuo della materia. Lo stesso Dalton interpretò la legge appena scoperta riesumando la vecchia ipotesi atomica di Democrito. Però, rispetto all’intuizione del filosofo greco, in cui l’atomo era qualche cosa di metafisico priva di qualsiasi riscontro sperimentale, l’idea del chimico inglese aveva invece il pregio di fondarsi su solide basi sperimentali.
L’IDEA ATOMICA DI DALTON
Un’ipotesi scientifica, come sappiamo, trae origine da fatti sperimentali, deve spiegare in modo coerente i fatti stessi da cui proviene e deve inoltre essere in grado di avanzare previsioni su comportamenti che si possono verificare in un secondo momento.
L’idea di Dalton era che la materia fosse fatta di atomi di tipo diverso per quanti erano gli elementi chimici esistenti in natura. Inoltre, durante le trasformazioni gli atomi dovevano rimanere interi aggregandosi semplicemente in modo diverso a seconda del tipo di composto che si andava costituendo. Tutte queste idee traevano origine in modo naturale e senza forzature dall’analisi delle leggi sperimentali che erano state individuate alla fine del 1700 dai chimici francesi Antoine-Laurent de Lavoisier (1743-1794) e Joseph Louis Proust (1754-1826), oltre a quella di Dalton di cui abbiamo appena detto.
Il ragionamento che condusse Dalton alla formulazione della sua ipotesi potrebbe essere stato il seguente. Noi non possiamo vedere la struttura intima della materia, tuttavia se immaginiamo l’esistenza di corpuscoli elementari, siamo in grado di giustificare in modo coerente e chiaro il comportamento della materia a livello osservabile. Ora, poiché gli elementi semplici, come ad esempio idrogeno e ossigeno, compaiono nelle sostanze da essi formate in rapporti di peso definiti e costanti, tali rapporti dovrebbero rispecchiare i rapporti fra i pesi degli atomi caratteristici di ciascun elemento. In altre parole, la reazione chimica in grande, non è altro che l’insieme di tante reazioni in piccolo fra i singoli atomi.
Poiché l’esperimento mostrava che una certa quantità in peso di idrogeno (per esempio 1 grammo) si combinava con un peso otto volte maggiore di ossigeno (quindi 8 grammi) per formare acqua, allora anche un singolo atomo di idrogeno si combinava con un singolo atomo di ossigeno qualora le due masse di idrogeno e ossigeno messe a reagire contenessero lo stesso numero di particelle. In altri termini il singolo atomo di ossigeno dovrebbe pesare 8 volte di più di un singolo atomo di idrogeno qualora le due quantità di idrogeno e ossigeno messe a reagire pesassero in rapporto di 1 a 8. Tuttavia, l’ipotesi che la molecola di acqua (o atomo composto, come chiamava Dalton la singola particella di acqua) fosse costituita da un atomo di idrogeno legato ad un atomo di ossigeno era del tutto arbitraria in quanto non era motivata da alcuna evidenza sperimentale. Comunque, se veramente fosse stato come supposto, la formula chimica, ossia la scrittura sintetica e simbolica dell’acqua sarebbe stata HO (dove H sta per idrogeno e O per ossigeno).
Come abbiamo accennato il rapporto ponderale di idrogeno e ossigeno che partecipano alla formazione di acqua, tratto dall’esperienza, non poteva di per sé dimostrare alcunché sulla composizione della particella minima del composto. Se ad esempio nel recipiente che conteneva l’idrogeno vi fosse stato un numero di particelle doppio di quello presente nel recipiente di ossigeno allora l’atomo di ossigeno sarebbe pesato non 8, ma 16 volte di più dell’atomo di idrogeno e di conseguenza la formula chimica dell’acqua sarebbe stata H2O, ma altre supposizioni si potrebbero fare.
Rimaneva il fatto che per scrivere la formula chimica di un composto era necessario conoscere il peso dei singoli atomi che partecipavano alla costituzione del composto stesso. Si osservi tuttavia che per raggiungere lo scopo non è indispensabile la conoscenza dei pesi assoluti dei singoli atomi quelli in grammi, per intenderci, ma sarebbe sufficiente la conoscenza dei pesi relativi, per esempio relativi all’atomo di idrogeno.
LA LEGGE DEI VOLUMI DI COMBINAZIONE FRA GAS
Nello stesso anno in cui veniva resa pubblica l’ipotesi atomica di Dalton (1808), il chimico francese Joseph Louis Gay-Lussac (1778-1850), formulava la quarta legge fondamentale delle reazioni chimiche, riguardante, questa volta, le combinazioni tra i volumi di sostanze allo stato gassoso. Egli aveva osservato che i gas si combinavano fra loro per formare composti secondo rapporti di volumi esprimibili da numeri interi. Ancora una volta affiorava quindi la natura discontinua della materia.
Se si misuravano ad esempio i volumi di idrogeno e ossigeno che reagivano per formare acqua, mantenendo identiche le condizioni di temperatura e pressione nei due recipienti, si osservava che un certo volume di ossigeno reagiva sempre con un volume doppio di idrogeno e se l’acqua che si otteneva veniva portata anch’essa allo stato di vapore, risultava contenuta in un volume uguale a quello in cui era contenuto l’idrogeno. Pertanto si poteva scrivere: 1 volume di ossigeno + 2 volumi di idrogeno → 2 volumi di acqua (vapore).
Gli stessi risultati si ottenevano con altre sostanze allo stato gassoso: esse reagivano sempre secondo rapporti volumetrici dati da numeri piccoli e interi. Le regolarità di comportamento che abbiamo mostrato possono venire espresse attraverso la seguente legge, detta legge volumetrica delle reazioni chimiche: “Quando due gas, posti nelle stesse condizioni di temperatura e di pressione, reagiscono, i loro volumi stanno in rapporto esprimibile da numeri interi e piccoli tra loro e anche con il prodotto della reazione, se questo, a sua volta, è un gas”.
È possibile giustificare questa legge con l’ipotesi atomica di Dalton? Prendiamo ad esempio il caso dell’idrogeno che reagisce con il cloro, entrambi gas, per formare il cloruro di idrogeno (detto anche acido cloridrico) anch’esso gassoso. L’esperienza mostra che un volume di un litro di idrogeno si combina con un identico volume di cloro per formare due litri di cloruro di idrogeno.
Poiché si osserva che a reazione avvenuta, risultano svuotati sia il recipiente contenente idrogeno sia quello del cloro, bisogna supporre che nei due recipienti non ci possa stare una quantità qualsiasi di gas, ma, o contengono entrambi lo stesso numero di atomi, oppure uno dei due contiene un numero di atomi multiplo dell’altro. Ammettiamo ad esempio che nei due recipienti vi sia lo stesso numero di atomi, allora si deve verificare che ad ogni atomo di idrogeno corrisponde un atomo di cloro e la formula del composto dovrebbe essere HCl, dove H sta per idrogeno e Cl per cloro. Se invece si ammette, sempre per fare un esempio, che gli atomi contenuti nel recipiente del cloro siano il doppio di quelli contenuti nel recipiente di ugual volume di idrogeno vorrebbe dire che il composto si è formato per l’unione, ripetuta innumerevoli volte, di un atomo di idrogeno con due atomi di cloro. La formula del composto sarebbe ora HCl2 ma ancora una volta si sarebbe osservato che allo svuotamento del primo recipiente è corrisposto lo svuotamento completo dell’altro. È certo che gli atomi contenuti nei due volumi uguali di idrogeno e di cloro non possono essere in numero qualsiasi perché in tal caso allo svuotamento di un recipiente non corrisponderebbe lo svuotamento completo dell’altro. Avanzerebbe sempre qualcosa o da una parte o dall’altra.
Ai tempi di Dalton il comportamento dei gas era già sufficientemente noto e tra l’altro si sapeva che sottoponendo i gas a variazioni di temperatura e di pressione questi si comportavano tutti allo stesso modo, dilatandosi o comprimendosi indipendentemente dalla loro natura chimica. Era come se il numero di particelle contenute in volumi uguali di gas diversi fosse sempre lo stesso. Dalton pensò proprio a questo e cioè che “volumi di gas diversi nelle stesse condizioni di temperatura e pressione contengono lo stesso numero di atomi”.
Tuttavia, nonostante la logicità e la coerenza di tutte le premesse l’ipotesi atomica di Dalton non riusciva a dare giustificazione della legge sperimentale di Gay-Lussac. Nella figura riportata sotto è possibile osservare che ammettendo la presenza nei due recipienti di partenza di un numero uguale di particelle ad esempio 3 per volume si vengono a formare con la reazione tre particelle doppie che dovrebbero essere contenute in un volume della stessa capienza di quello dell’idrogeno (o del cloro). L’esperienza mostra invece che il volume del cloruro di idrogeno che si forma in seguito alla reazione è doppio di quello dell’idrogeno (o del cloro) di partenza. Il fatto che le particelle composte siano di dimensioni maggiori rispetto a quelle degli atomi semplici non deve trarre in inganno in quanto la grandezza delle particelle composte è irrilevante rispetto alle notevoli distanze esistenti fra le particelle stesse.
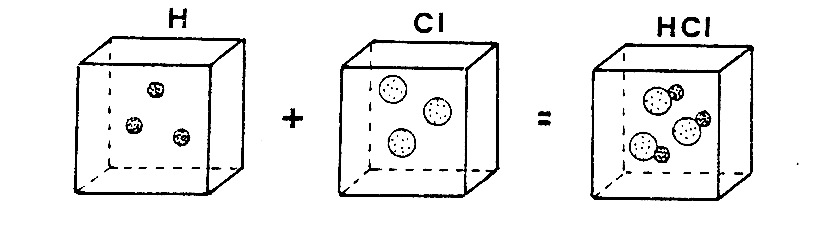
Schematizzazione della legge di Gay- Lussac, secondo l’interpretazione di Dalton. Se idrogeno e cloro fossero costituiti da atomi singoli, da 1 volume di idrogeno e 1 volume di cloro si sarebbe dovuto ottenere 1 volume di cloruro di idrogeno. L’esperienza mostra invece che il volume di cloruro di idrogeno che si ottiene dalla reazione è doppio.
Il mancato accordo tra l’ipotesi di Dalton e la legge di Gay-Lussac poteva essere addebitato a due soli motivi: o nei recipienti di idrogeno e cloro non erano contenuti atomi, oppure la legge di Gay-Lussac non era valida a causa degli errori commessi nell’assunzione dei dati sperimentali.
IL PRINCIPIO DI AVOGADRO
Fu sufficiente apportare una piccola modifica all’ipotesi da Dalton per superare tutte le difficoltà che erano emerse nel tentativo di giustificare la legge volumetrica di Gay-Lussac. La correzione, piccola ma geniale, all’ipotesi atomica fu formulata nel 1811 da uno scienziato torinese di nobile famiglia il cui nome era Amedeo Carlo Avogadro, conte di Quaregna e Cerreto. Essa è detta Principio di Avogadro e può essere enunciata nel modo seguente: “Volumi uguali di gas diversi, nelle stesse condizioni di temperatura e di pressione, contengono lo stesso numero di molecole”.
Si tratta di un principio, cioè di un’ipotesi fondamentale, che però non trae origine da fatti sperimentali, ma che tuttavia è in grado di spiegarne un gran numero senza trovarne mai uno solo che la contraddica. L’affermazione precedente di Dalton può sembrare analoga al Principio di Avogadro, ma questi parla di molecole, mentre Dalton parlava di atomi.
Per Avogadro la molecola era la particella più piccola che possiede tutte le proprietà chimiche e fisiche della sostanza a cui appartiene e può essere costituita da un aggregato di atomi di tipo diverso o uguale o anche da un singolo atomo. La diifferenza con l’dea di Dalton stava nel fatto che la particella minima di cui era costituito un elemento non doveva essere necessariamente un atomo, poteva essere anche una molecola.
In realtà, il Principio di Avogadro riusciva a dare spiegazione chiara e naturale della legge di Gay-Lussac, come si può vedere dalla figura riportata qui sotto. Se i recipienti che contengono gli elementi semplici si riempiono ad esempio di molecole biatomiche, invece che di atomi singoli, appare subito chiaro il motivo per il quale da un litro di idrogeno e un litro di cloro si devono formare due litri di cloruro di idrogeno.
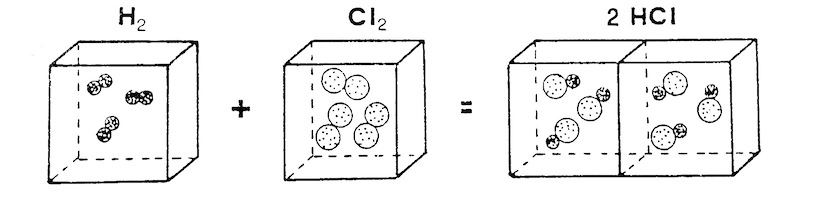
Schematizzazione della legge di Gay-Lussac, secondo l’interpretazione di Avogadro. Se idrogeno e cloro fossero costituite di molecole biatomiche, da 1 volume di idrogeno e 1 volume di cloro si otterrebbero 2 volumi di cloruro di idrogeno, in accordo con l’esperienza.
Si tenga presente tuttavia che al tempo di Avogadro nulla autorizzava a ritenere che il numero degli atomi che costituivano le molecole degli elementi semplici come idrogeno, ossigeno o cloro dovesse essere due. Una cosa è certa comunque e cioè che le molecole di quei gas non potevano essere costituite da un numero dispari di atomi e tanto meno da uno solo, mentre poteva trattarsi di un numero pari qualsiasi, anche superiore a due.
Eppure, nonostante che l’intuizione di Avogadro spiegasse con chiarezza e precisione i fatti sperimentali, essa non venne accettata dagli scienziati dell’epoca. La ragione di ciò va ricercata essenzialmente nel fatto che in quel tempo aveva largo credito la teoria dualistica del chimico svedese Jöns Jacob Berzelius (1779-1848). Questa teoria fu desunta dagli esperimenti che seguirono alla scoperta della pila da parte del fisico italiano Alessandro Volta (1745-1827), nel 1800.
Si era allora osservato che certe soluzioni (ma non tutte) conducevano la corrente elettrica, permettendo la separazione dei costituenti dei composti presenti in soluzione ai terminali della pila, cioè agli elettrodi, immersi nella soluzione stessa. Si venivano così a separare frammenti di materia carichi di elettricità di segno opposto. Berzelius quindi, sulla scorta di esperimenti limitati, si convinse che tutti i composti chimici erano formati da una parte elettricamente positiva e da una parte elettricamente negativa. Egli cioè dava per scontato il fatto, non dimostrato, che i legami fra gli atomi fossero in tutti i casi di natura elettrica. Di conseguenza, poiché due atomi uguali avrebbero dovuto possedere carica elettrica uguale essi si sarebbero dovuti respingere e non già attrarre. Per tale motivo non sarebbero dovute esistere molecole biatomiche costituite di atomi uguali come H2, O2, Cl2.
Berzelius godeva di grande prestigio e autorità nel mondo accademico e non intendendo rinunciare per alcun motivo alla sua teoria, dimostrava di aver assimilato molto male i dettami del metodo scientifico. La sua testardaggine finì col portare fuori strada gli scienziati dell’epoca ostacolando il progresso della chimica per cinquanta anni. Avogadro morirà nel 1856 senza aver visto riconosciuta l’esattezza delle sue idee.
DETERMINAZIONE DI PESO ATOMICO E PESO MOLECOLARE
Il 2 settembre 1860 si tenne a Karlsruhe, in Germania, il primo Congresso Internazionale di Chimica con l’obiettivo di risolvere il problema dei pesi atomici e delle formule chimiche, entro il quale vi era una grande confusione. In quell’occasione venne rivalutata finalmente la figura di Avogadro da parte di Stanislao Cannizzaro (1826-1910) un giovane professore di origine siciliana che insegnava all’Università di Genova. Egli dimostrò che attraverso il principio di Avogadro era possibile determinare peso atomico e peso molecolare delle sostanza e decidere di conseguenza il numero degli atomi che compone le molecole delle sostanze semplici come idrogeno, ossigeno o cloro e scrivere quindi correttamente le formule chimiche delle sostanze. Prima di procedere è necessario dare una definizione di quello che in chimica si intende per peso atomico e peso molecolare.
Si definisce peso atomico (PA) di un elemento il numero che esprime il rapporto tra la massa di un atomo di quell’elemento e la massa dell’atomo di un altro elemento preso a riferimento. Si definisce peso molecolare (PM) di un composto il numero che esprime il rapporto fra la massa di una molecola di quel composto e la massa di un atomo di riferimento. Per la precisione è necessario chiarire che il peso atomico e il peso molecolare sono in realtà la massa atomica e la massa molecolare in quanto si tratta di numeri puri che esprimono rapporti fra masse e quindi sono relativi alla massa dell’atomo di riferimento. Inizialmente venne scelto come atomo di riferimento quello dell’idrogeno, l’elemento più leggero esistente in natura: ad esso fu assegnato, convenzionalmente, peso atomico uguale a 1.
Si osservi ora che l’affermazione contenuta nel principio di Avogadro consente di determinare in modo immediato il peso molecolare delle sostanze allo stato gassoso. Basta infatti confrontare le masse di volumi uguali di due gas diversi per ricavare quante volte il peso di una singola molecola di un gas è superiore al peso di una molecola di un altro. Se ad esempio si pone su un piatto della bilancia un litro di ossigeno ad una precisa temperatura e pressione e sull’altro piatto si pone un litro di idrogeno alla stessa temperatura e pressione, il rapporto fra le due masse risulta uguale al rapporto fra le masse di due singole molecole di gas in quanto i due recipienti uguali contengono lo stesso numero di molecole. Pertanto, se il peso del volume di un litro di ossigeno risultasse essere 16 volte superiore al peso del volume di un litro di idrogeno anche la molecola di ossigeno peserebbe 16 volte di più della molecola di idrogeno.
Analogamente si può operare per gli altri gas. Ad esempio, un litro di azoto pesa 14 volte di più di un litro di idrogeno e quindi una molecola di azoto pesa 14 volte di più di una molecola di idrogeno. Il peso della molecola di anidride carbonica, il gas che si sviluppa durante la fermentazione del mosto, pesa 22 volte di più del peso della molecola di idrogeno.
Se poi si riuscisse a stabilire che la molecola di idrogeno è formata di due atomi, assegnato il valore 1 al peso dell’atomo di idrogeno, la molecola di idrogeno peserebbe 2, quella di ossigeno peserebbe 32, quella di azoto 28 e quella di anidride carbonica 44.
È forse opportuno rimarcare il fatto che il metodo che abbiamo indicato per la determinazione dei pesi molecolari delle sostanze allo stato gassoso ha validità del tutto generale, nel senso che non è necessario scegliere il peso dell’atomo di idrogeno come peso di confronto, andrebbe bene il peso di un atomo o di una molecola di un’altra sostanza qualsiasi. In tutti i casi si otterrebbe una scala di pesi molecolari i cui valori risulterebbero tra loro proporzionali.
Vediamo ora, per mezzo di un esempio concreto, in che cosa consiste il metodo di Cannizzaro per determinare il peso atomico dell’ossigeno. Si deve allora prendere in considerazione un gran numero di sostanze allo stato gassoso, o riducibili a tale stato, che contengano ossigeno. Si determina quindi per ciascuna sostanza il peso molecolare e, attraverso l’analisi ponderale, le percentuali di ossigeno presenti in esse. Infine, attraverso il calcolo, si ricava la quantità di ossigeno contenuta nel valore del peso molecolare del composto. Si ottiene in questo modo una serie di numeri il più piccolo dei quali (vedi ultima colonna della tabella riportata qui sotto) viene considerato il peso dell’atomo di ossigeno. Ora, poiché la molecola di ossigeno pesa 32, vuol dire che essa è formata di due atomi.
| Sostanze allo Peso Percentuale Quantità di Ossigeno
stato aeriforme molecolare di Ossigeno contenuta nel peso molecolare Acqua 18 88,89 16 Acqua ossigenata 34 94,12 32 Ossido di carbonio 28 57,14 16 Ossigeno puro 32 100,00 32 Anidride nitrica 108 74,08 80 Anidride solforica 80 60,00 48
|
Nello stesso modo si procede per la determinazione dei pesi atomici di altri elementi come ad esempio idrogeno e cloro. Certamente, applicando questo metodo, non vi è la garanzia che non si possa incontrare, in seguito, un composto nel quale l’elemento di cui si sta determinando il peso atomico non assuma il valore di un sottomultiplo del valore più basso fino ad allora riscontrato. Nel caso dell’ossigeno si potrebbe ad esempio trovare il valore di 8; in tale circostanza la molecola di ossigeno sarebbe tetratomica e non biatomica. Oggi esistono svariati sistemi per la determinazione dei pesi atomici e molecolari delle sostanze che hanno confermato i valori trovati da Cannizzaro. Con ciò siamo certi che le molecole di gas di sostanze semplici come idrogeno, ossigeno e cloro sono tutte biatomiche. La conoscenza dei pesi atomici e dei pesi molecolari delle sostanze permise di scrivere le formule corrette delle molecole dei composti. La formula chimica di un composto non è quindi qualche cosa di astratto, frutto dell’immaginazione dell’uomo, calata dall’alto e da imparare a memoria, ma una costruzione simbolica risultato di rigorose operazioni sperimentali e di successive elaborazioni matematiche. La formula chimica contiene pertanto un preciso significato qualitativo e quantitativo relativo alla costituzione della sostanza che rappresenta. In chimica si fa distinzione fra formula minima (o empirica) e formula molecolare. La prima dà informazione semplicemente sul tipo di atomi che caratterizza la sostanza e sul loro rapporto di combinazione, la seconda esprime invece anche il numero esatto degli atomi che sono contenuti nella molecola della sostanza. Per l’acqua, ad esempio, una volta stabilito, attraverso l’analisi ponderale, che essa è composta di idrogeno e ossigeno nel rapporto in peso di 1 a 8, e stabilito inoltre, attraverso il metodo indicato da Cannizzaro, che il peso dell’atomo di ossigeno è 16, rispetto al peso dell’atomo di idrogeno fatto uguale a 1, risulta che la formula minima non può che essere H2O. Per l’acqua ossigenata, invece, per la quale il rapporto ponderale fra idrogeno e ossigeno risulta di 1 a 16, la formula minima sarà HO. Per determinare poi la formule molecolari è necessario conoscere oltre che i rapporti di combinazione fra gli elementi, anche i pesi molecolari. Per l’acqua, ad esempio, il cui peso molecolare è 18, la formula minima e la formula molecolare coincidono; per l’acqua ossigenata, invece, il cui peso molecolare è 34, la formula molecolare è H2O2, mentre la formula minima, come abbiamo visto, era HO.
Nello stesso modo si procede per la determinazione dei pesi atomici di altri elementi come ad esempio idrogeno e cloro. Certamente, applicando questo metodo, non vi è la garanzia che non si possa incontrare, in seguito, un composto nel quale l’elemento di cui si sta determinando il peso atomico non assuma il valore di un sottomultiplo del valore più basso fino ad allora riscontrato. Nel caso dell’ossigeno si potrebbe ad esempio trovare il valore di 8; in tale circostanza la molecola di ossigeno sarebbe tetratomica e non biatomica. Oggi esistono svariati sistemi per la determinazione dei pesi atomici e molecolari delle sostanze che hanno confermato i valori trovati da Cannizzaro. Con ciò siamo certi che le molecole di gas di sostanze semplici come idrogeno, ossigeno e cloro sono tutte biatomiche. La conoscenza dei pesi atomici e dei pesi molecolari delle sostanze permise di scrivere le formule corrette delle molecole dei composti. La formula chimica di un composto non è quindi qualche cosa di astratto, frutto dell’immaginazione dell’uomo, calata dall’alto e da imparare a memoria, ma una costruzione simbolica risultato di rigorose operazioni sperimentali e di successive elaborazioni matematiche. La formula chimica contiene pertanto un preciso significato qualitativo e quantitativo relativo alla costituzione della sostanza che rappresenta. In chimica si fa distinzione fra formula minima (o empirica) e formula molecolare. La prima dà informazione semplicemente sul tipo di atomi che caratterizza la sostanza e sul loro rapporto di combinazione, la seconda esprime invece anche il numero esatto degli atomi che sono contenuti nella molecola della sostanza. Per l’acqua, ad esempio, una volta stabilito, attraverso l’analisi ponderale, che essa è composta di idrogeno e ossigeno nel rapporto in peso di 1 a 8, e stabilito inoltre, attraverso il metodo indicato da Cannizzaro, che il peso dell’atomo di ossigeno è 16, rispetto al peso dell’atomo di idrogeno fatto uguale a 1, risulta che la formula minima non può che essere H2O. Per l’acqua ossigenata, invece, per la quale il rapporto ponderale fra idrogeno e ossigeno risulta di 1 a 16, la formula minima sarà HO. Per determinare poi la formule molecolari è necessario conoscere oltre che i rapporti di combinazione fra gli elementi, anche i pesi molecolari. Per l’acqua, ad esempio, il cui peso molecolare è 18, la formula minima e la formula molecolare coincidono; per l’acqua ossigenata, invece, il cui peso molecolare è 34, la formula molecolare è H2O2, mentre la formula minima, come abbiamo visto, era HO.
Prof. Antonio Vecchia


